Brisure de symétrie et migration cellulaire
Sciences et technologies
Article
L'équipe de Martial Balland, chercheur au Laboratoire interdisciplinaire de physique de Grenoble (LIPhy - CNRS / Université Grenoble Alpes) s’est interrogée sur la brisure de symétrie à l’origine de l’initiation d’un processus migratoire. En collaboration avec plusieurs équipes françaises travaillant à l’interface entre la physique et la biologie, ils ont identifié un nouveau mécanisme à l’origine de la migration cellulaire. Cette découverte a été récemment publiée dans la revue Science Advances et sa contribution à la compréhension du mouvement cellulaire pourrait éventuellement mener à de nouvelles stratégies diagnostiques et thérapeutiques.
Le mouvement cellulaire est un processus fondamental chez tous les organismes vivants : du mouvement coordonné des cellules pendant la morphogénèse des embryons, à la patrouille continuelle des cellules immunitaires durant la vie adulte. Comprendre comment et pourquoi une cellule commence à se déplacer est une question fondamentale en biologie car elle est reliée à la genèse des formes chez les organismes multicellulaires. En effet le mouvement cellulaire peut engendrer des mouvements morphogénétiques tel que l’extension de l’embryon pendant les stades précoces de son développement. C’est aussi une question à visée applicative dans le domaine médical puisque la dissémination des tumeurs par métastase repose sur le passage qu'effectue une cellule cancéreuse d'un état statique à un état migratoire.
L'équipe de Martial Balland chercheur au LIPhy s’est interrogée sur la brisure de symétrie à l’origine de l’initiation d’un processus migratoire. En collaboration avec plusieurs équipes françaises travaillant à l’interface entre la physique et la biologie, ils ont identifié un nouveau mécanisme à l’origine de la migration cellulaire. Cette découverte a été récemment publiée dans la revue Science Advances et sa contribution à la compréhension du mouvement cellulaire pourrait éventuellement mener à de nouvelles stratégies diagnostiques et thérapeutiques.
Pour se déplacer les cellules doivent exercer des forces sur l’environnement qui les entoure au même titre que nous exerçons des pressions sur le sol avec nos pieds lorsque nous marchons. Pour ce faire, les cellules possèdent un réseau interne de fibres contractiles (le cytosquelette) leur permettant de produire des forces mécaniques, de la même façon que le réseau de fibres musculaires du biceps exerce des forces mécaniques sur le bras. Les forces que les cellules génèrent sont transmises à leur microenvironnement par l’intermédiaire de protéines adhésives décorant la membrane cellulaire. "Bien que le mouvement cellulaire ait fait l'objet de nombreuses études, la recherche dans ce domaine demeure toujours très active et reste une tâche difficile en raison de sa grande complexité. En effet, la brisure de symétrie à l’échelle cellulaire repose sur l’orchestration complexe de centaines de signaux biochimiques intracellulaires. De plus, les cellules changent continuellement de formes en réponse aux propriétés physiques et chimiques du milieu environnant" explique Katharina Hennig, première auteure de l'étude. "Pour réduire cette complexité, nous avons conçu un système in vitro, nous permettant de confiner les cellules sur des pistes protéiques micrométriques. Ces pistes sont imprimées sur des substrats déformables nous permettant, à la manière d’un 'podologue cellulaire', de cartographier les zones d’appuis des cellules se déplaçant".
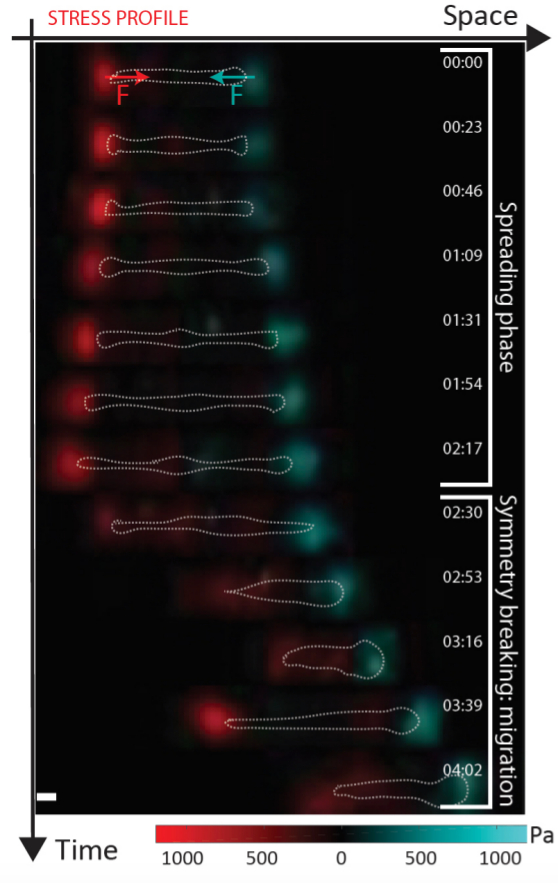
L'approche développée était basée sur une technique de micro-fabrication issue de la microélectronique. "L’utilisation des outils provenant des technologies microélectroniques présente un double avantage : (i) nous pouvons imprimer des milliers de lignes sur une lamelle de microscope et ainsi paralléliser un grand nombre de mesures (ii) nous réduisons le problème à une dimension, il devient donc extrêmement facile d’observer une brisure de symétrie, la cellule n’ayant le choix qu’entre deux directions pour se déplacer" explique le Dr Balland. En utilisant une combinaison d'expériences issues de la biologie, telle que l’optogénétique, et de la physique, telle que l’imagerie de forces cellulaires, Hennig et al. ont découvert un nouveau mécanisme montrant que les cellules sont capables de passer spontanément d'un comportement statique à un comportement mobile. Les principaux acteurs sont les molécules qui sont en contact direct avec le monde extérieur. À l’état statique la cellule à tendance à s’étaler de manière symétrique, cet étalement a pour effet d’augmenter la tension au sein du corps cellulaire. Cette tension entre en compétition avec la dynamique des molécules adhésives permettant à la cellule de s’accrocher à son environnement extérieur. Lorsque la tension liée à l’allongement cellulaire devient trop grande pour être supportée par les molécules adhésives, l'une des deux extrémités cellulaires se détache spontanément. Cela conduit à une diminution du niveau des forces que la cellule exerce, une diminution de la longueur de la cellule et finalement à l'initiation du mouvement. "Ces observations nous ont permis de mettre en évidence une corrélation très intéressante entre la longueur d'une cellule et sa capacité à se mettre en mouvement. En fait, les petites cellules ont tendance à plus se déplacer, et à se déplacer plus vite. Cela signifie que nous pouvons prédire la mobilité des cellules simplement en regardant leur taille, sans effectuer d'autres mesures plus complexes", ajoute le Dr Hennig. La facilité de cette mesure de longueur cellulaire couplée à l’aspect "haut débit" de ces micro-pistes pour la culture cellulaire présente un potentiel d’aide au diagnostic dans la détection de cellules métastatiques tout en limitant le volume de cellules prélevées sur des patients. "Pour conclure, une des choses les plus importantes à noter dans le cadre de ce travail, c’est qu’il n’aurait jamais était réalisable sans la mise en commun d’expertises dans différentes disciplines et c’est donc avant tout un travail d’équipes multi-disciplinaires qui ont fonctionné en synergie" conclut Martial Balland.
L'équipe de Martial Balland chercheur au LIPhy s’est interrogée sur la brisure de symétrie à l’origine de l’initiation d’un processus migratoire. En collaboration avec plusieurs équipes françaises travaillant à l’interface entre la physique et la biologie, ils ont identifié un nouveau mécanisme à l’origine de la migration cellulaire. Cette découverte a été récemment publiée dans la revue Science Advances et sa contribution à la compréhension du mouvement cellulaire pourrait éventuellement mener à de nouvelles stratégies diagnostiques et thérapeutiques.
Pour se déplacer les cellules doivent exercer des forces sur l’environnement qui les entoure au même titre que nous exerçons des pressions sur le sol avec nos pieds lorsque nous marchons. Pour ce faire, les cellules possèdent un réseau interne de fibres contractiles (le cytosquelette) leur permettant de produire des forces mécaniques, de la même façon que le réseau de fibres musculaires du biceps exerce des forces mécaniques sur le bras. Les forces que les cellules génèrent sont transmises à leur microenvironnement par l’intermédiaire de protéines adhésives décorant la membrane cellulaire. "Bien que le mouvement cellulaire ait fait l'objet de nombreuses études, la recherche dans ce domaine demeure toujours très active et reste une tâche difficile en raison de sa grande complexité. En effet, la brisure de symétrie à l’échelle cellulaire repose sur l’orchestration complexe de centaines de signaux biochimiques intracellulaires. De plus, les cellules changent continuellement de formes en réponse aux propriétés physiques et chimiques du milieu environnant" explique Katharina Hennig, première auteure de l'étude. "Pour réduire cette complexité, nous avons conçu un système in vitro, nous permettant de confiner les cellules sur des pistes protéiques micrométriques. Ces pistes sont imprimées sur des substrats déformables nous permettant, à la manière d’un 'podologue cellulaire', de cartographier les zones d’appuis des cellules se déplaçant".

Une cellule sur les starting blocks : cartographie des zones d'appuis (rouge et bleu) d'une cellule au moment du déclenchement d'un processus migratoire.
L'approche développée était basée sur une technique de micro-fabrication issue de la microélectronique. "L’utilisation des outils provenant des technologies microélectroniques présente un double avantage : (i) nous pouvons imprimer des milliers de lignes sur une lamelle de microscope et ainsi paralléliser un grand nombre de mesures (ii) nous réduisons le problème à une dimension, il devient donc extrêmement facile d’observer une brisure de symétrie, la cellule n’ayant le choix qu’entre deux directions pour se déplacer" explique le Dr Balland. En utilisant une combinaison d'expériences issues de la biologie, telle que l’optogénétique, et de la physique, telle que l’imagerie de forces cellulaires, Hennig et al. ont découvert un nouveau mécanisme montrant que les cellules sont capables de passer spontanément d'un comportement statique à un comportement mobile. Les principaux acteurs sont les molécules qui sont en contact direct avec le monde extérieur. À l’état statique la cellule à tendance à s’étaler de manière symétrique, cet étalement a pour effet d’augmenter la tension au sein du corps cellulaire. Cette tension entre en compétition avec la dynamique des molécules adhésives permettant à la cellule de s’accrocher à son environnement extérieur. Lorsque la tension liée à l’allongement cellulaire devient trop grande pour être supportée par les molécules adhésives, l'une des deux extrémités cellulaires se détache spontanément. Cela conduit à une diminution du niveau des forces que la cellule exerce, une diminution de la longueur de la cellule et finalement à l'initiation du mouvement. "Ces observations nous ont permis de mettre en évidence une corrélation très intéressante entre la longueur d'une cellule et sa capacité à se mettre en mouvement. En fait, les petites cellules ont tendance à plus se déplacer, et à se déplacer plus vite. Cela signifie que nous pouvons prédire la mobilité des cellules simplement en regardant leur taille, sans effectuer d'autres mesures plus complexes", ajoute le Dr Hennig. La facilité de cette mesure de longueur cellulaire couplée à l’aspect "haut débit" de ces micro-pistes pour la culture cellulaire présente un potentiel d’aide au diagnostic dans la détection de cellules métastatiques tout en limitant le volume de cellules prélevées sur des patients. "Pour conclure, une des choses les plus importantes à noter dans le cadre de ce travail, c’est qu’il n’aurait jamais était réalisable sans la mise en commun d’expertises dans différentes disciplines et c’est donc avant tout un travail d’équipes multi-disciplinaires qui ont fonctionné en synergie" conclut Martial Balland.
Cette étude a été réalisée dans le groupe du Dr Martial Balland au Laboratoire interdisciplinaire de physique de Grenoble (UMR 5588 - Université Grenoble Alpes / CNRS). Cette étude a été financée par la Fondation Nanoscience, la Fondation ARC, et la subvention ANR-17-CE30-0032-01 de l'Agence nationale de la recherche française. Ces travaux ont été partiellement soutenus par le LabeX Tec 21 (Investissements d'Avenir : convention de subvention n° ANR-11-LABX-0030). Le co-auteur correspondant est le Dr Raphael Voituriez du Laboratoire de Physique Théorique de la Matière Condensée, Paris, France.
Publié le4 février 2020
Mis à jour le21 février 2020
Mis à jour le21 février 2020
Vous aimerez peut-être aussi
- The Conversation Junior : "Alec et Eloa : « Pourquoi est-ce que quand on monte en haut d’une montagne il fait plus froid alors qu’on se rapproche du Soleil ? »"
- The Conversation : "Images de science : Le métal qui se prenait pour du verre"
- The Conversation : "Tuer pour la science ? Une nouvelle expérience de Milgram"
- The Conversation : "Le rêve de Jeff Bezos ou peut-on, vraiment, rajeunir en reprogrammant nos cellules ?"
Références
K. Hennig, I. Wang, P. Moreau, L. Valon, S. DeBeco, M. Coppey, Y. A. Miroshnikova, C. Albiges-Rizo, C. Favard, R. Voituriez, M. Balland, Stick-slip dynamics of cell adhesion triggers spontaneous symmetry breaking and directional migration of mesenchymal cells on one-dimensional lines. Science Advances 03 Jan 2020: Vol. 6, no. 1, eaau5670.

