Ces chercheurs qui font repousser les nerfs
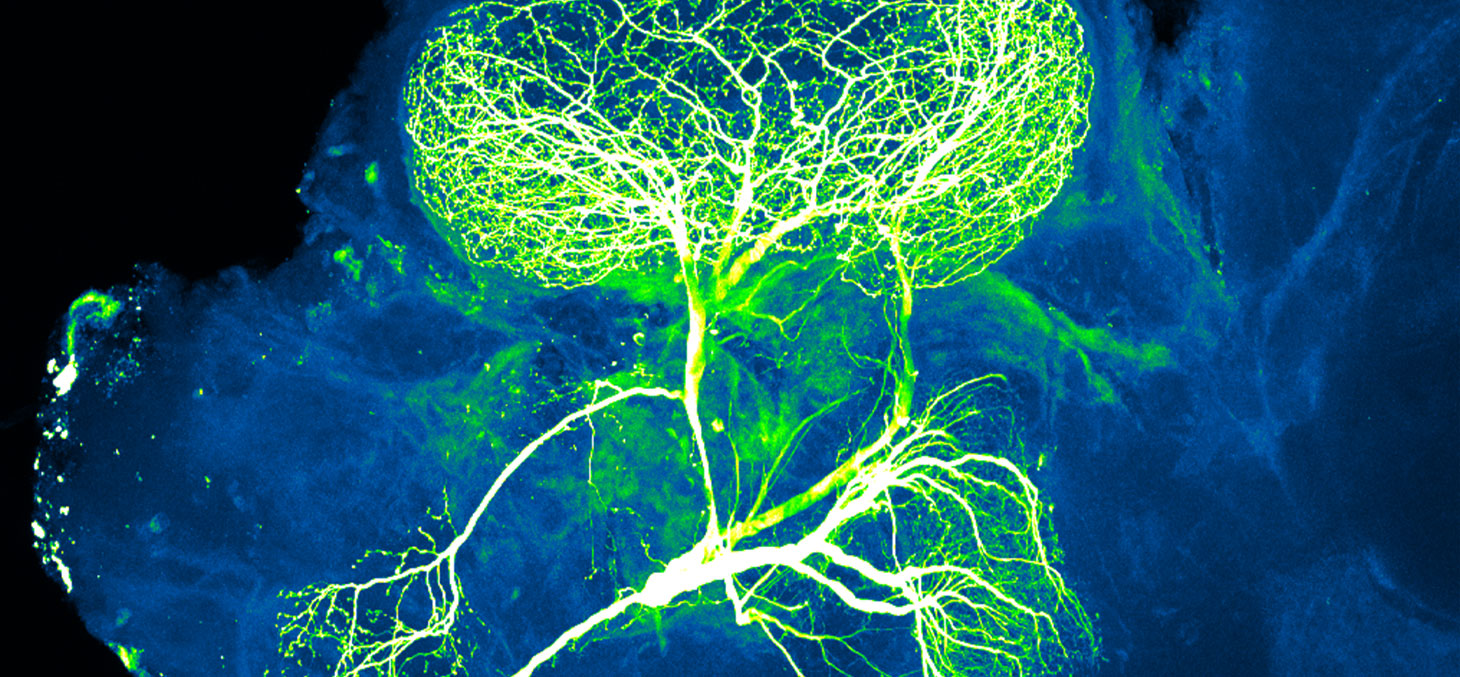
Avec le même espoir, celui de permettre à des personnes paralysées de remarcher, d’autres scientifiques explorent une voie totalement différente. Ils cherchent le moyen de réparer les lésions du système nerveux central. Plusieurs équipes sont ainsi parvenues, dans leurs laboratoires, à faire repousser des nerfs sur plusieurs centimètres.
Ces travaux ouvrent des perspectives pour les personnes touchées à la colonne vertébrale après un accident, mais aussi celles qui ont gardé des séquelles après un accident vasculaire cérébral (AVC) ayant touché la marche ou le langage, ou encore celles atteintes par le glaucome, une maladie du nerf optique. Cependant, plusieurs difficultés doivent encore être surmontées avant de pouvoir envisager, un jour, de régénérer ainsi nos fibres nerveuses sur commande.
Nous ressentons et interagissons avec le monde qui nous entoure grâce à nos neurones. Les plus connus sont ceux logés dans notre cerveau, mais il en existe d’autres, présents dans l’ensemble de notre corps. En effet, c’est grâce à ces cellules très spéciales que nous pouvons penser, ressentir la douleur, la chaleur, le vent sur notre visage, marcher, courir, ou bien contrôler les fonctions de notre organisme tel que nos battements cardiaques.
Ces neurones possèdent de longs prolongements, les axones, qui forment ce qu’on appelle les « nerfs ». Les axones permettent au système nerveux de se connecter avec ses cibles que sont les muscles, les vaisseaux sanguins ou encore les intestins, et de les contrôler.
Un système nerveux capable de se régénérer, l’autre pas
Mais la nature aimant compliquer les choses, le corps humain est formé de deux systèmes nerveux dont les capacités de réparation sont diamétralement opposées. Le premier est le système nerveux périphérique (SNP). Il est composé de tous les nerfs qui innervent les muscles, les os, les organes. Ceux-là possèdent la capacité de se régénérer après une lésion.
Ainsi il y a deux ans, les médecins de l’hôpital pour enfants de Philadelphia, aux États-Unis, ont accompli une prouesse chirurgicale en transplantant deux bras à un jeune garçon de 8 ans. Les médecins ont recousu les nerfs de l’enfant avec ceux des bras greffés. La cicatrice liée à la suture se résorbe et rapidement, les nerfs ne font plus qu’un. La réussite de l’opération souligne le formidable pouvoir de régénérescence du SNP.
Le système nerveux central (SNC) comprend, lui, le cerveau et la moelle épinière. Le SNC est fragile, donc très protégé. Ainsi le cerveau se trouve à l’abri dans la boîte crânienne et la moelle épinière, à l’intérieur de la colonne vertébrale. Cet écrin osseux est nécessaire car le SNC est totalement incapable de se réparer après une lésion. La partie touchée finit par en mourir.
Chute, AVC ou glaucome peuvent endommager les fibres nerveuses
Les neurones du SNC peuvent être endommagés lors d’un AVC, du fait de maladies neurodégénératives comme la SLA, Alzheimer ou le glaucome (qui touche le nerf optique) ou lors de traumatismes comme une chute ou un accident de voiture. Si ces fibres nerveuses sont touchées, les fonctions cognitives ou motrices qu’elles commandent sont définitivement perdues.
C’est ainsi que l’acteur jouant le rôle de Superman dans les années 1970, Christopher Reeves, était resté tétraplégique après une chute de cheval. Aujourd’hui décédé, il avait vécu de longues années paralysé après une blessure de la moelle épinière au niveau du cou.
Dans la quête d’une guérison des lésions du SNC, une première avancée importante a été obtenue au début des années 1980 par deux chercheurs canadiens de l’université McGill, Samuel David et Albert Juan Agayo. Ils ont démontré que l’environnement de la lésion, c’est-à-dire les cellules formant les tissus qui entourent les neurones, joue un rôle clé dans les mécanismes qui les empêchent de se régénérer.
Depuis cette découverte, des efforts importants ont été déployés pour caractériser cet environnement, mettant en évidence la barrière physique qu’elle forme à la repousse. On a identifié quelles molécules inhibitrices présentes dans ces tissus étaient reconnues par les axones comme des signaux inhibiteurs de repousse.
Chez l’embryon, les neurones possèdent la capacité de repousse
Les chercheurs s’interrogent aussi sur le rôle des neurones eux-mêmes dans le processus de la régénérescence. En effet, chez l’embryon et le fœtus, les neurones du SNC possèdent la capacité de repousse après une blessure. Après la naissance, en revanche, ce n’est plus le cas. Ainsi l’équipe du professeur de neurologie Zhigang He à l’Université de Harvard, aux États-Unis, a approché le problème sous un angle nouveau : et si le problème ne venait pas tant des tissus autour, mais plutôt des neurones eux-mêmes ?
Pour tenter de répondre à cette question, l’équipe de Harvard a renoncé à prendre comme objet d’étude la moelle épinière, système difficile à manipuler et extrêmement complexe – on ne sait pas quel neurone est touché de façon précise par la lésion. Les chercheurs ont choisi le nerf optique, qui appartient au SNC et permet d’étudier non seulement la repousse de l’axone – leur sujet d’étude – mais aussi la survie des neurones, un aspect crucial dans les maladies neurodégénératives comme le glaucome.
Les chercheurs ont stimulé, chez la souris, des voies de signalisation moléculaires qui sont actives pendant le développement de l’embryon. Et montré ainsi, en 2008, que les axones du nerf optique peuvent repousser après une lésion, des résultats publiés dans la prestigieuse revue Science. Depuis cette avancée spectaculaire, de nombreuses molécules permettant la croissance des axones après une lésion ont été découvertes. De façon intéressante, les effets de la plupart de ces molécules peuvent être transposés dans d’autres parties du SNC telle que la moelle épinière, ouvrant de véritables perspectives thérapeutiques.
Une repousse sur quelques centaines de micromètres
Ces molécules permettent la repousse de l’axone à courte distance, soit quelques centaines de micromètres. Seulement il est extrêmement rare que la lésion se produise à proximité des cibles visées par les axones, de sorte que cette faible croissance est insuffisante pour permettre le retour des fonctions perdues. Bien souvent, plusieurs centimètres seraient nécessaires. Pour une lésion au niveau cervical, par exemple, il faudrait une repousse sur plusieurs dizaines de centimètres pour retrouver la mobilité des membres inférieurs.
Cette question critique a été le centre des travaux que j’ai menés après ma thèse lors de mon passage dans l’équipe de Zhigang He, de 2010 à 2016. En déterminant comment les neurones réagissent au cours de leur développement mais aussi après une lésion, j’ai pu mettre en évidence trois voies de signalisation critiques pour leur bonne croissance. La modulation simultanée de ces trois voies, chez la souris, a permis de franchir l’obstacle resté jusqu’ici insurmontable de la repousse sur une longue distance.

En effet, nous avons réussi à obtenir une régénérescence suffisamment puissante pour faire repousser les axones de l’œil sur 1 à 2 centimètres jusque vers leurs cibles dans le cerveau.

Avions-nous touché au but ? Réparer le SNC pouvait alors paraître à notre portée. C’était sans compter sur un phénomène surprenant observé non seulement dans nos travaux mais aussi par d’autres équipes. En effet, une moitié des axones suit correctement son chemin vers sa cible. Mais l’autre moitié des axones qui repoussent semble être complètement perdue… et se dirige n’importe où. Or si l’on permet aux axones de repousser sans bien les diriger et que les neurones, au final, se connectent aux mauvaises cibles, on s’expose à de graves problèmes. Par exemple, des circuits véhiculant des informations de douleur complètement anarchiques peuvent se former.

Chez l’embryon et le fœtus, des milliers de faisceaux d’axones naviguent sur de longues distances afin de se connecter de façon très spécifique à leur cible. Ces mécanismes seraient-ils conservés, d’une façon ou d’une autre, chez l’adulte ? Peut-on trouver de nouveaux processus pour conduire les axones qui repoussent à bonne destination, jusqu’à leurs cibles ?
Ces interrogations, centrales pour les années à venir, sont les moteurs de l’équipe que je dirige à l’Institut des Neurosciences de Grenoble, à l’Université Grenoble-Alpes. Nous utilisons pour cela une combinaison de techniques comme l’imagerie, les cultures de neurones et la production de virus non dangereux qui nous permettent de transporter dans l’organisme des molécules d’intérêt thérapeutique.
![]() Tandis que nous tentons de régénérer les neurones endommagés, que le neurochirurgien Alim-Louis Benabid teste le principe d’un exosquelette, d’autres équipes s'efforcent de guérir autrement le même type de patients. En Suisse, l’équipe du neurobiologiste Grégoire Courtine essaie de mettre en place des interfaces homme/machine. À l’université de San Diego, aux États-Unis, le groupe du professeur de neurosciences Marc Tuszynski explore de son côté l’utilisation de cellules souches. C’est la combinaison de ces différentes approches, cellulaire, moléculaire et robotique, toutes aussi importantes les unes que les autres, qui donne l’espoir de parvenir à réparer un jour les atteintes du système nerveux central.
Tandis que nous tentons de régénérer les neurones endommagés, que le neurochirurgien Alim-Louis Benabid teste le principe d’un exosquelette, d’autres équipes s'efforcent de guérir autrement le même type de patients. En Suisse, l’équipe du neurobiologiste Grégoire Courtine essaie de mettre en place des interfaces homme/machine. À l’université de San Diego, aux États-Unis, le groupe du professeur de neurosciences Marc Tuszynski explore de son côté l’utilisation de cellules souches. C’est la combinaison de ces différentes approches, cellulaire, moléculaire et robotique, toutes aussi importantes les unes que les autres, qui donne l’espoir de parvenir à réparer un jour les atteintes du système nerveux central.
La version originale de cet article a été publiée sur The Conversation.
Mis à jour le4 juillet 2017
Vous aimerez peut-être aussi
- The Conversation Junior : "Alec et Eloa : « Pourquoi est-ce que quand on monte en haut d’une montagne il fait plus froid alors qu’on se rapproche du Soleil ? »"
- The Conversation : "Images de science : Le métal qui se prenait pour du verre"
- The Conversation : "Tuer pour la science ? Une nouvelle expérience de Milgram"
- The Conversation : "Le rêve de Jeff Bezos ou peut-on, vraiment, rajeunir en reprogrammant nos cellules ?"
L' auteur
The Conversation
theconversation.com
Abonnez-vous !
theconversation.com/fr/newsletter

