Grâce à un procédé inédit, des scientifiques ont pu filmer les processus ultra-rapides à l'œuvre dans les protéines fluorescentes, largement utilisées comme marqueur en imagerie du vivant.
Ce nouveau procédé, qui utilise des lasers gigantesques aux rayons X, permet d’étudier les processus tels que la vision, la bioluminescence et d'autres jusqu'ici inobservables. Ces travaux sont publiés dans
Nature Chemistry le 11 septembre 2017 par une collaboration internationale impliquant les scientifiques du CEA, du CNRS, de l’Université Grenoble-Alpes¹, de Lille, de Rennes 1 et Paris-Sud, ainsi que l’Institut Max-Planck de Heidelberg en Allemagne.
La microscopie optique super-résolution, ou « nanoscopie », a révolutionné l’imagerie du vivant, grâce au marquage des molécules à imager avec des protéines fluorescentes dites « photo-commutables ». Ces minuscules interrupteurs moléculaires passent réversiblement d’un état fluorescent (
on) à un état éteint (
off) après excitation par un flash lumineux (on parle de photo-commutation). Pour les concevoir sur mesure, il est nécessaire de comprendre leurs mécanismes de photo-commutation, qui impliquent des états transitoires ultra-rapides.
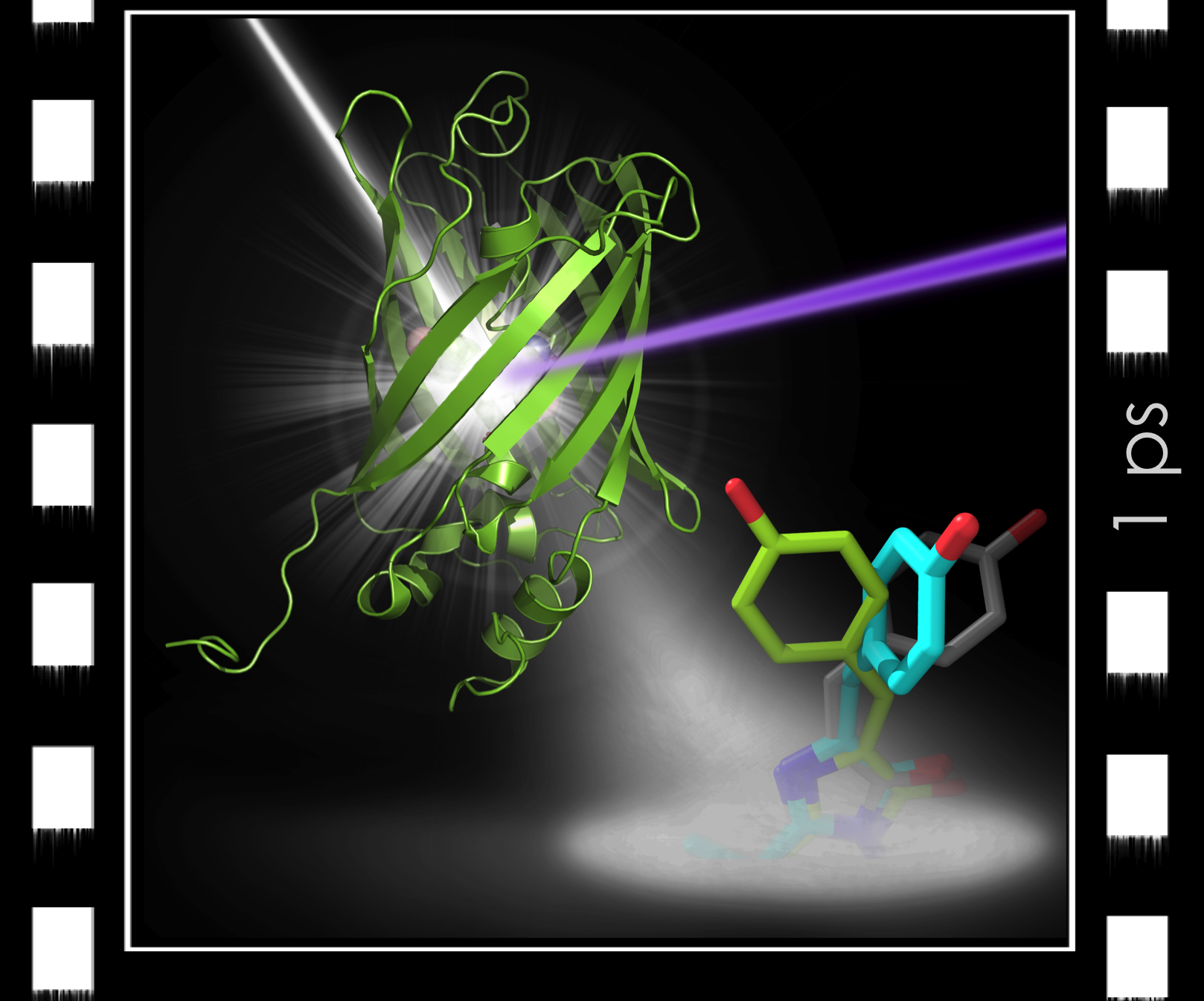 © Virgile Adam / IBSFigure : Cinéma ultra-rapide d’une protéine en action. La protéine fluorescente (verte) est excitée par un laser de lumière visible (rayon violet) et impactée par une impulsion de rayons X (rayon blanc) produite par un laser X à électrons libres. Une picoseconde après excitation, le chromophore (bleu) au cœur de la protéine est observé à mi-chemin entre les deux formes stables (‘off’ en gris, ‘on’ en vert) ; sa vitesse de déplacement (4,6 Angströms en 1 picoseconde) correspond à celle d’un avion supersonique (460 m / s) !
© Virgile Adam / IBSFigure : Cinéma ultra-rapide d’une protéine en action. La protéine fluorescente (verte) est excitée par un laser de lumière visible (rayon violet) et impactée par une impulsion de rayons X (rayon blanc) produite par un laser X à électrons libres. Une picoseconde après excitation, le chromophore (bleu) au cœur de la protéine est observé à mi-chemin entre les deux formes stables (‘off’ en gris, ‘on’ en vert) ; sa vitesse de déplacement (4,6 Angströms en 1 picoseconde) correspond à celle d’un avion supersonique (460 m / s) !
Pour la première fois, les scientifiques ont pu filmer la commutation en temps réel d'une protéine fluorescente en utilisant une toute nouvelle génération de source de rayons X, les lasers à électrons libres (XFEL, pour
X-ray free electron laser). Ces dispositifs produisent des impulsions de rayons X très courtes de l’ordre de la femtoseconde (un millionième de milliardième de seconde) et très intenses au cœur d'une installation longue de plusieurs kilomètres.
Au centre de l'accélérateur linéaire de Stanford (
SLAC Linear Accelerator Center), les auteurs de l’étude ont fait coïncider un flux de minuscules cristaux de la protéine fluorescente avec les impulsions de rayons X, collectant ainsi une myriade de clichés de diffraction. Étant donné l’extrême intensité du faisceau de rayons X, chaque cristal impacté explose immédiatement après que l’information de diffraction a été collectée – d’où la nécessité de constamment renouveler l’échantillon dans cette technique dite de « cristallographie sérielle ». Pour observer des états intermédiaires entre les deux états statiques
on et
off, la réaction photochimique est provoquée dans la protéine par un flash laser lumineux déclenché à peine une picoseconde (un millième de milliardième de seconde) avant l’impact d’une impulsion de rayons X.
C’est ainsi que les auteurs ont pu déterminer la structure transitoire de la protéine fluorescente dans son état excité, et observer le chromophore – la partie de la protéine qui absorbe la lumière – dans un état tordu (« twisté »), à mi-chemin entre les conformations stables des états
on et
off (
cf. figure). Cette observation, confirmée par des simulations, a permis aux chercheurs d’émettre des hypothèses sur le mécanisme de photo-commutation de la protéine. Ces hypothèses ont ensuite pu être vérifiées grâce à la mutagénèse dirigée.
Seuls deux lasers X à électrons libres sont actuellement opérationnels au monde : celui qui a été utilisé pour cette étude à Stanford, dans la Silicon Valley aux Etats-Unis (instrument LCLS du SLAC National Accelerator Laboratory), et l’autre au Japon, dans la province d’Osaka (SACLA). Le premier laser à électrons libres européen, auquel la France a contribué, sera mis en service fin 2017 à Hambourg (Allemagne) et l’une des premières expériences prévues sera menée par le consortium auteur de cette étude. Il promet un avenir radieux au cinéma moléculaire.
 © SLAC National Accelerator LaboratoryInstallation du SLAC National Accelerator Laboratory, basée aux États-Unis. Les chercheurs ont utilisé ce laser X long de plusieurs kilomètres pour « filmer » les changements conformationnels internes d’une protéine, soit des mouvements de quelques Angströms (10-10 mètres) qui se déroulent en quelques millièmes de milliardièmes de seconde.
© SLAC National Accelerator LaboratoryInstallation du SLAC National Accelerator Laboratory, basée aux États-Unis. Les chercheurs ont utilisé ce laser X long de plusieurs kilomètres pour « filmer » les changements conformationnels internes d’une protéine, soit des mouvements de quelques Angströms (10-10 mètres) qui se déroulent en quelques millièmes de milliardièmes de seconde.
- Ces trois organismes collaborent au sein de l’Institut de biologie structurale.