Des chercheurs de l'European molecular biology laboratory et de l’Institut pour l'avancée des biosciences découvrent une nouvelle méthode pour tester des médicaments anti-inflammatoires inspirée par le dialogue moléculaire entre notre système immunitaire et un agent pathogène : Toxoplasma gondii.
Toxoplasma gondii est l’agent pathogène responsable de la toxoplasmose, une infection quasiment asymptomatique chez les personnes immunocompétentes mais qui peut se manifester sévèrement chez les individus dont le système immunitaire est affaibli (infection VIH, cancérothérapies, greffes) ou immature (toxoplasmose congénitale).
Toxoplasma crée des conditions d’inflammation appropriées pour permettre au parasite d’effectuer son cycle infectieux sans mettre en péril la survie de son hôte. Des scientifiques du
European molecular biology laboratory (
EMBL) et de l’Institut pour l'avancée des biosciences (
IAB - Inserm / CNRS / Université Grenoble Alpes) ont découvert une des nombreuses voies empruntées par le parasite pour maintenir le système immunitaire sous contrôle et publient, le 23 novembre 2016, leur résultats dans le journal
Structure.
"
Ce parasite remodèle la réponse inflammatoire de l'hôte", explique Matthew Bowler de l'EMBL. "
Il subvertit ainsi les voies de signalisation qui normalement participe aux défenses de notre corps."
Quand une cellule détecte dans votre corps un parasite, elle déclenche une réaction en chaîne. À l'intérieur de cette cellule, une série de molécules s'activent mutuellement jusqu'à ce qu'une protéine appelée p38 alpha soit activée et se déplace dans le noyau de la cellule où elle y active les gènes qui déclenchent la réponse inflammatoire. Le but ultime de cette réponse est d'éliminer l'agent pathogène. On pourrait s'attendre à ce que des parasites comme
Toxoplasma veuillent surmonter cette réponse, mais Mohamed-Ali Hakimi et ses collègues de l'IAB ont découvert il y a quelques années que
Toxoplasma sécrète une protéine, GRA24, qui fait tout le contraire : elle active de manière permanente notre réponse inflammatoire.
Matthew Bowler et Mohamed-Ali Hakimi ont découvert que GRA24 a la propriété de court-circuiter cette cascade de réactions en provoquant l’autophosphorylation prolongée de p38 alpha, puis son accumulation dans le noyau de la cellule infectée. En utilisant une combinaison de techniques structurales, ils ont découvert que GRA24 s'attache beaucoup plus fortement à p38 alpha et entre en compétition avec les protéines de la cellule infectée. Donc, en produisant une protéine qui se lie directement, et très étroitement, à p38 alpha,
Toxoplasma vient contrôler le niveau de la réponse inflammatoire en rendant inaccessible p38 alpha aux protéines qui normalement viennent l’inactiver. C'est pourquoi le toxoplasme n’est pas considéré comme une grave menace pour la santé, sauf pour les femmes enceintes et les personnes ayant un système immunitaire compromis.
Le mécanisme d’action de GRA24 sur p38 alpha a permis de découvrir une nouvelle façon d'évaluer l'efficacité des anti-inflammatoires, dont beaucoup sont conçus pour bloquer p38 alpha. Jusqu'à présent, il était difficile d'évaluer leur efficacité, parce que les scientifiques n’avaient pas la possibilité de produire dans de bonnes conditions une forme active de p38 alpha en laboratoire. En co-produisant GRA24 associé à p38 alpha, Matthew Bowler, Mohamed-Ali Hakimi et ses collègues – avec l'aide de la plate-forme scientifique
Protein expression and purification de l’EMBL – ont ouvert la voie à un nouvel outil de criblage de candidat-médicaments ciblant spécifiquement p38 alpha dans son état actif.
Le fait de pouvoir exploiter comment
Toxoplasma détourne une des plus anciennes voies de transduction du signal impliquée dans l’immunité des animaux a ainsi permis le développement d’un outil de criblage d’anti-inflammatoires ciblant p38 alpha.
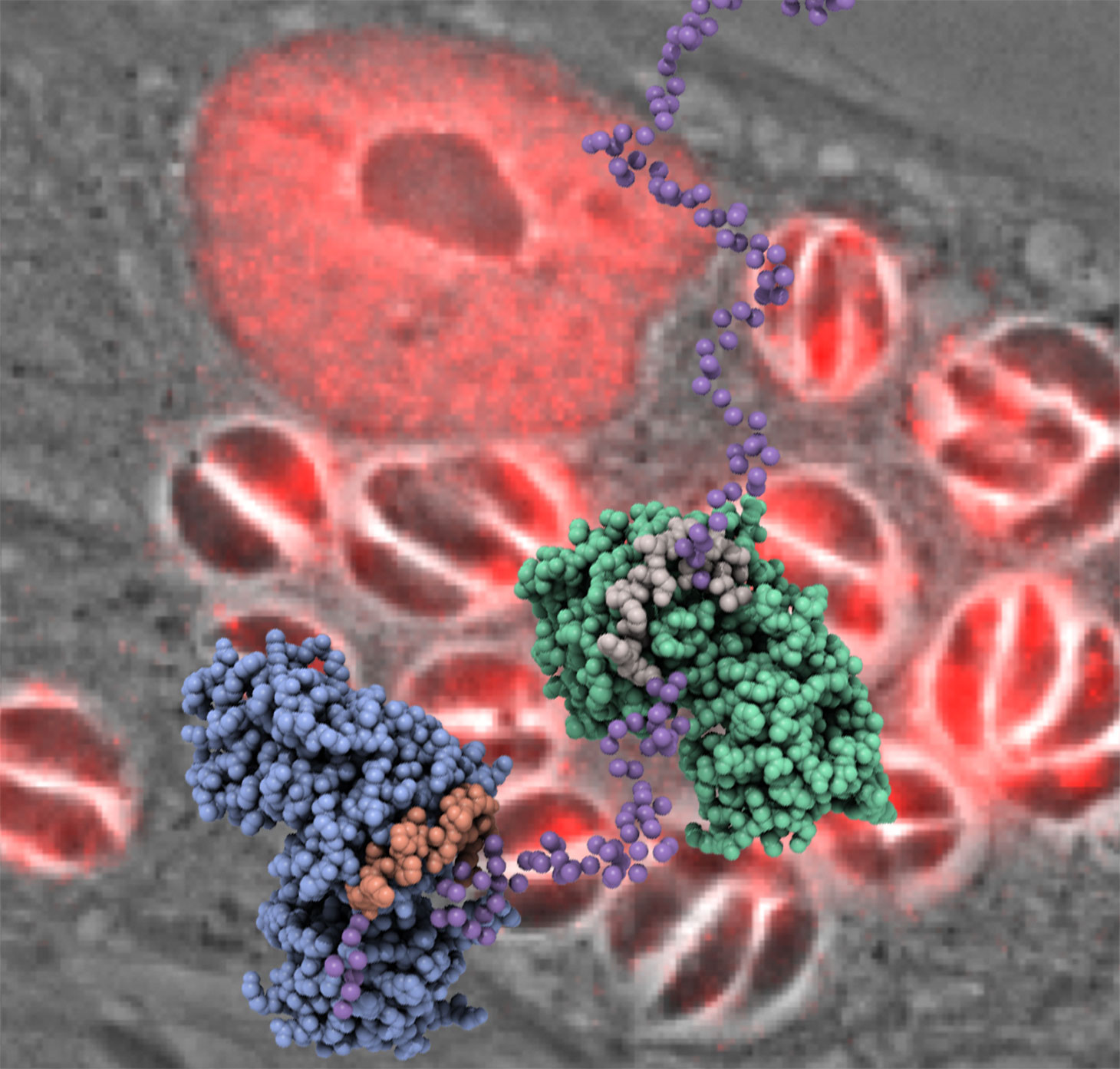 La structure de GRA24 (billes violettes), une protéine intrinsèquement désordonnée, liée au p38 alpha humain (vert et bleu) est montrée au premier plan. En arrière-plan la protéine GRA24 (en rouge) est secrétée par le parasite dans le noyau de la cellule humaine infectée.
La structure de GRA24 (billes violettes), une protéine intrinsèquement désordonnée, liée au p38 alpha humain (vert et bleu) est montrée au premier plan. En arrière-plan la protéine GRA24 (en rouge) est secrétée par le parasite dans le noyau de la cellule humaine infectée.
© Matthew Bowler (EMBL) & Mohamed-Ali Hakimi (IAB)